A asma é a doença preexistente mais encontrada na gravidez. Estudos epidemiológicos demonstram associação de 3,7 a 8,4% entre asma brônquica e gravidez (1,2), enquanto que o estado de mal asmático atinge de 0,05 a 2% do total das grávidas (3). A asma durante a gravidez pode resultar em aumento da letalidade materna perinatal (4), prematuridade e retardo no crescimento intra-uterino, com baixo peso do recém-nato (5). Bahna e Bjerkdal (6) encontraram aumento significativo de partos prematuros e baixo peso fetal em 381 pacientes com asma em comparação a 112.530 grávidas não-asmáticas. Pacientes com asma sem tratamento conveniente apresentam elevada mortalidade e maior incidência de oligoidrâmnia, hiperêmese gravídica (7), toxemia, hipertensão gestacional (8) e hemorragia vaginal espontânea (7).
A gravidez produz alterações anatômicas e funcionais no aparelho respiratório. Ocorrem modificações na configuração do tórax, nos volumes pulmonares, no metabolismo e no drive ventilatório.
Com a progressão da gravidez o tórax toma a forma de um tonel, com a abertura gradual das últimas costelas. O ângulo subcostal aumenta gradualmente de 68º no início da gravidez, para 103º no termo. O diafragma se eleva em ± 4 cm, tornando-se mais curvo, ampliando a base do tórax em 2 cm (diâmetro transverso), com conseqüente aumento em sua capacidade de gerar pressão. Ressalte-se que a respiração na gravidez é do tipo predominantemente diafragmática, com um menor componente costal.
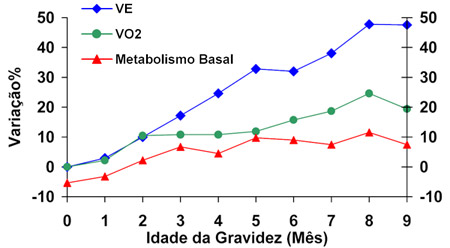
Durante a gravidez evidenciam-se alterações fisiológicas na respiração que devem ser destacadas. Ocorrem elevações no consumo de oxigênio, na produção de CO2 e na ventilação alveolar. No curso do ciclo gravídico ocorrem aumentos nas concentrações hormonais, salientando-se a progesterona que ascende de cerca de 30 mg/24h, na fase secretória, para 75 mg/24h na metade da gestação, atingindo os 250 mg/24h no termo (9). Atribui-se às concentrações elevadas de progesterona, a hiperventilação fisiológica da gravidez (conhecida como "dispnéia da gravidez"), sendo que ao final da gestação ocorre um aumento de 20-40% na ventilação minuto (VE) (Figura 1) (10,11). A hiperventilação ocorre por aumento do drive respiratório central, por ativação de receptores de progesterona concentrados no hipotálamo e no hipocampo. O aumento da VE se dá em função da elevação do volume corrente, mantendo-se a freqüência respiratória inalterada. A taquipnéia durante a gravidez (irpm > 20/min) é um achado anormal e deve ser investigado.
No sangue arterial a hiperventilação determina uma elevação da PaO2 (102-106 mmHg), uma hipocapnia com PaCO2 em torno de 28-30 mmHg, com uma redução compensatória do bicarbonato sérico para 18-22 mmol/l, com perfil ácido-básico de alcalose respiratória leve crônica (pH 7,44) (12,13) (Tabela 1). Deve ser ressaltado que uma PCO2 de 40 mmHg pode representar hipoventilação materna.
Tabela 1 — Parâmetros da gasometria arterial em grávidas e não-grávidas
pH PaO2 mmHg PCO2 mmHg
Não-grávidas 7,4 91-95 36-39,4
Grávidas 7,43-7,46 102-106 28-30
Outras alterações acontecem nos volumes estáticos, com reduções de 4-6% na CPT e de 15-25% no VR e na CRF devido à elevação diafragmática causada pelo aumento do volume uterino (14). A queda progressiva da CRF está associada a diminuição da complacência torácica, devido ao efeito mecânico do aumento do volume uterino comprimindo o compartimento abdominal. A queda na CRF pode entretanto, exacerbar a hipoxemia devido ao fechamento prematuro das pequenas vias aéreas quando a asma aguda complica a gravidez. A CV, o PFE e o VEF1 não se modificam (15,16), enquanto a capacidade inspiratória (CI) aumenta. A DLCO aumenta durante a gravidez sem que haja uma explicação consistente, não sendo explicada pelas alterações da concentração da hemoglobina, volume alveolar ou concentração de estrogênio (17). O aumento fisiológico da DLCO que ocorre na posição supina está ausente ou diminuído na gravidez. Uma explicação para esta constatação relaciona-se ao aumento do débito cardíaco que normalmente se eleva na posição supina em não-grávidas porém cai nas grávidas devido à compressão da veia cava inferior (Tabela 2).
O volume plasmático aumenta durante a gravidez, com modificações na sua composição. O conteúdo em água do plasma e do soro eleva-se de cerca de 91,5% no início da gestação, para mais de 92% no terceiro trimestre (18), podendo ter participação no edema das mucosas nasal e brônquica, com conseqüente elevação na resistência ao fluxo aéreo.
A obstrução nasal é comum durante a gravidez e é devida a hiperemia e ao edema da mucosa. A obstrução nasal acentua a sensação de dispnéia, sendo importante diferenciar a "dispnéia normal" da gravidez por hiperventilação fisiológica, da dispnéia patológica que está associada à redução do PFE e VEF1 ou a hipoxemia.
Vários estudos demonstram que nas grávidas com asma leve intermitente, ou com leve persistente controlada com corticóide tópico, a gravidez transcorre sem maiores problemas para a mãe e para o feto, enquanto que na asma mais severa, o broncoespasmo determina um aumento adicional na ventilação minuto, visando manutenção da PaO2. Levando-se em conta a hiperventilação basal da gravidez, que determina uma redução na reserva muscular, este esforço adicional para vencer o aumento da resistência das vias aéreas pode determinar fadiga muscular mais precoce e insuficiência respiratória.
Outro ponto a ser considerado refere-se ao ciclo respiratório materno-fetal. Como a PaO2 fetal corresponde a aproximadamente 1/3 da PaO2 de um adulto, a hipoxemia decorrente de um ataque de asma aguda ou asma crônica malcontrolada poderá ocasionar sérias complicações fetais. Um estudo utilizando experimentação animal com ovelhas, demonstrou que quando a saturação de oxigênio materna cai de 98 para ~58%, a saturação fetal cai de 62% para 27% (18). A placenta pode ser considerada como uma membrana que separa o fluxo sangüíneo materno uterino do fluxo sangüíneo umbilical. A perfusão materna da placenta se faz pelas artérias uterinas que se dividem em vasos progressivamente menores até formarem as arteríolas espirais, responsáveis pela perfusão do espaço interviloso e "banham" as vilosidades fetais. O sangue materno deixa o espaço interviloso pelas vênulas uterinas que se unem até formar a veia uterina. A circulação uteroplacentária é um sistema de trocas por contracorrente, resultando em significativa shuntagem. A passagem transplacentária de oxigênio ocorre por difusão. Enquanto a diferença entre a PO2 alveolar e a do sangue venoso materno é de 70 mmHg, na placenta, entre o sangue interviloso e o fetal a oxigenar, é de somente 35 mmHg. Não há dúvidas de que o feto vive em ambiente hipóxico sendo que uma hipoxemia materna pode ter severas conseqüências no feto (19). Quando de respiração materna em ar ambiente com FI O2 de 21%, a PO2 da artéria umbilical (sangue fetal venoso) é de 15 mmHg e a PO2 da veia umbilical (sangue arterial fetal) é de somente 31 mmHg. As microcirculações materna e fetal operam em conjunto e o sangue venoso umbilical equilibra-se com o sangue venoso uterino. Desta forma, a PO2 venosa umbilical fetal se aproxima da PO2 venosa materna uterina, no entanto, sem excedê-la.
Alguns mecanismos de adaptação do feto minimizam esta hipoxemia, e assim podem ser sumarizados (19,20):
1 Alto débito cardíaco fetal;
2 Uma parcela do metabolismo fetal transcorre em anaerobiose;
3 A espessura da barreira placentária por onde ocorre a difusão do O2 diminui progressivamente à medida que a gravidez chega a termo (25 µ no início da gestação, alcançando ao termo de 2 a 6 µ, na média 3,7µ);
4 Elevam-se no final da gravidez a hematimetria e hemoglobinometria (15-18 g/l) do feto;
5 O desvio da curva de dissociação da hemoglobina fetal favorece uma maior liberação de O2 para o feto. Para uma mesma pressão parcial de oxigênio, a saturação do sangue fetal é maior que o sangue materno;
6 Os shunts fetais (ductus arteriosus, foramen ovale) direcionam a maior parte do sangue para órgãos vitais;
7 Aumento do fluxo sanguíneo do feto para a placenta .
Durante a gravidez ocorrem alterações fisiológicas que podem modificar o curso da asma. Podemos dividir em alterações que melhoram a asma e aquelas que pioram a asma.
Melhoram a Asma (7,21)
— Broncodilatação mediada pela progesterona;
— Potencialização da broncodilatação ß-adrenérgica mediada pela progesterona ou estrogênios;
— Aumento do cortisol livre plasmático;
— Aumento do AMPc;
— Aumento da resposta Beta-adrenérgica mediada pelos glucocorticóides;
— Diminuição da broncoconstrição mediada pela histamina plasmática (devido ao aumento da histaminase circulante);
— Estabilização brônquica mediada pela prostaglandina I2;
— Broncodilatação mediada pela prostaglandina E;
— Broncodilatação induzida pelo peptídeo atrial-natriurético;
— Aumento da meia-vida ou redução da ligação protéica de broncodilatadores "endógenos" ou exógenos;
— Redução dos níveis de IgE que ocorre durante a gravidez.
Agravam a Asma (7,21)
— Refratariedade pulmonar aos efeitos do cortisol pela competitividade de ligação aos receptores de glucocorticóides pela progesterona aldosterona ou deoxicorticosterona;
— Broncoconstrição mediada pela prostaglandina F2a;
— Redução da CRF com fechamento das pequenas vias aéreas e redução dos índices de ventilação-perfusão;
— Aumento do refluxo gastroesofagiano;
— Aumento do stress e fatores psicológicos;
— Maior freqüência de sinusite durante a gravidez, 1,5% de todas as gravidezes, seis vezes mais que na população geral (22).
Como descrito, tanto a progesterona como o cortisol aumentam progressivamente no decurso da gravidez. Outros hormônios, como a aldosterona e a desoxicorticosterona que também se elevam no soro da grávida apresentam, entretanto, efeitos antagônicos sobre os receptores do cortisol (23), podendo ter participação na fisiopatologia da asma gravídica. Outras mudanças que podem explicar os efeitos da gravidez sobre a asma incluem a mudança da responsividade dos receptores ß2-agonistas, mudanças na inflamação brônquica decorrentes dos altos níveis de progesterona circulante e pela depressão da imunidade celular (24,25).
A gravidez considerada normal, fisiológica portanto, é considerada uma condição pró-inflamatória, típica TH2 (26). Além disso, na gravidez normal ocorre uma alteração na representação da sub-população leucocitária na circulação materna e está associada com a ativação sistêmica dos leucócitos (27). Uma resposta imune anormal em pacientes com pré-eclâmpsia é caracterizada pelo desvio TH2 para TH1 (28). Recentemente, foi sugerido que o desenvolvimento de respostas por citocinas TH2 esteja associada a exposição a altas concentrações de antígeno leucocitário humano solúvel HLA-G, mantendo viável a gravidez, enquanto que baixas concentrações de HLA-G aumentam a expressão de citocinas TH1 (29). Portanto as respostas imunes TH2 durante a gravidez promovem uma gestação de curso normal até o termo, todavia, não está elucidado se este predomínio TH2 normal da gravidez é capaz ou não de influenciar a asma da mãe atópica, exacerbando a doença no decurso de gestação.
O curso da asma na gravidez não pode ser previsto, podendo ocorrer tanto a estabilização, melhora ou piora. Um estudo recente de Schatz et al. (30) abrangendo 16 centros médicos avaliou uma população de 1.739 mulheres com asma e gravidez. Estas mulheres foram acompanhadas prospectivamente até o termo. A grande maioria foi classificada ao entrar no estudo como portadora de asma leve (50,2%) ou moderada (46,8%). Cerca de 3% apresentavam-se com doença severa. Durante o curso gestacional, 30% das mulheres inicialmente classificadas como asma leve migraram para a categoria moderada-severa, enquanto que 23% daquelas classificadas como moderada-severa se converteram a asma leve.
Pacientes com asma severa tendem a piorar durante a gravidez, enquanto que aquelas que apresentam asma leve tendem a melhorar (31). No estudo de Schatz et al. (30) as exacerbações durante a prenhez ocorreram em 12,6% das pacientes inicialmente classificadas como asma leve, 25,7% nas com asma moderada e 51,9% com asma severa. Existe propensão à exacerbação entre a 24ª e 36ª semanas, enquanto que as crises são pouco comuns durante o trabalho de parto ou no parto propriamente dito devido a elevação da prostaglandina E e cortisol na fase final da gravidez. O comportamento da asma nas gestações subseqüentes é semelhante às anteriores (4,31).
No que concerne ao diagnóstico diferencial da asma na gravidez, deve-se levar em consideração outras patologias associadas a dispnéia aguda e sibilância ocasional. Dentre elas (32-35): 1) hiperventilação na fase inicial ou tardia da gravidez que possa estar associada à dispnéia, sem que haja, entretanto, tosse, sibilos e sensação de opressão torácica; 2) miocardiopatia periparto idiopática; 3) terapia tocolítica associada ao edema pulmonar, relacionado à utilização de drogas simpaticomiméticas no trabalho de parto prematuro; 4) embolia de líquido amniótico; 5) embolia pulmonar.
Durante o ciclo gravídico-puerperal o acompanhamento especializado deve ser incentivado, objetivando-se um suporte terapêutico farmacológico, enfatizando-se o aspecto preventivo, mantendo-se o bem-estar materno-fetal, reafirmando-se a necessidade do controle ambiental, evitando-se possíveis fatores precipitantes da asma.
Tratamento da Asma:: Situações Específicas -Tratamento da Asma na Gravidez
Efeitos da Asma na Gravidez - Nova Hipótese Relacionada ao Baixo Peso de Fetos Femininos
Estudos têm sido efetuados em pacientes com asma durante a gravidez, objetivando explicar o porquê da maior freqüência de baixo peso em neonatos do sexo feminino. Uma interessante hipótese relaciona o baixo peso fetal a alteração da enzima placentária 11b-hidroxiesteróide dehidrogenase tipo 2 (11b-HSD2).
A placenta apresenta um papel importante no controle do crescimento fetal, fornecendo nutrientes e oxigênio provenientes da mãe. A placenta também previne a transferência de grandes concentrações de cortisol materno para o feto. A enzima 11b-HSD2 é a responsável por esta função, atuando como uma barreira, metabolizando o cortisol, transformando-o na forma inativa cortisona, prevenindo desta forma que o excesso de cortisol materno alcance o feto, iniba a função adrenal e o seu crescimento. Estudos já demonstraram que a atividade reduzida da 11b-HSD2 limita o crescimento fetal intra-uterino (36).
Murphy et al. (37) publicaram um estudo coorte com 138 pacientes com asma durante a gravidez (62 com asma leve, 28 com asma moderada e 48 com asma severa) e 44 controles, recrutadas no primeiro trimestre de gestação. Entre as pacientes com asma, 45 não estavam utilizando corticóides, sendo que a maioria se enquadrava na classificação de asma leve. Destas, 22 deram a luz a feto do sexo feminino e 23 do sexo masculino. Os autores observaram que o peso dos neonatos femininos de mães que não faziam uso de corticóides por inalação era significativamente menor quando comparado ao grupo controle e ao grupo das mães que utilizavam o medicamento. Este achado não foi detectado em neonatos masculinos, não se observando alteração de crescimento intra-uterino em meninos. Dosaram no parto as concentrações de estriol fetal (derivado do sulfato dehidroepiandrosterona adrenal fetal) e o cortisol na veia umbelical. Encontraram valores reduzidos de estriol e elevados de cortisol somente em fetos do sexo feminino de mães que não utilizavam corticóide por inalação. A redução do estriol no sangue do cordão umbelical indicava supressão da função adrenal como resultado do excesso de cortisol materno alcançando o feto. Concluíram que neonatos femininos podem apresentar um efeito adverso na asma materna, quando não tratadas com corticóides por inalação, determinando restrição no crescimento intra-uterino, via redução da atividade da 11b-HSD2.
A explicação estava associada ao significante aumento de monócitos no sangue periférico materno ao longo de toda a gestação, como conseqüência da inflamação brônquica pela não utilização de corticóide por inalação e na presença de feto feminino, acreditando-se que citocinas provenientes de monócitos circulantes podem ser primariamente responsáveis por alterações na função da placenta, o que resultaria em crescimento restrito de fetos somente do sexo feminino. Outra explicação seria a presença de um fator ainda desconhecido do feto feminino que alteraria a função imune materna. Este fator poderia ser um hormônio sexual feminino ou uma nova proteína originada no feto. Estudos anteriores indicam que os hormônios sexuais femininos alteram a liberação de citocinas por macrófagos (38). Murphy et al. propuseram que fatores derivados do feto poderiam também estar envolvidos em uma alteração do fenótipo monócito/macrófago.
Concluíram que a inflamação brônquica materna decorrente da asma pode estar diretamente relacionada a redução do metabolismo placentário do cortisol pela 11b-HSD2, e como conseqüência, interferência no eixo hipotálamo-hipófise-supra-renal de fetos femininos, reduzindo o seu crescimento.
Efeitos do sexo do feto na Asma durante a Gravidez
Existem relatos de piora da asma em pacientes portadoras de asma moderada ou severa durante o ciclo gravídico, quando estão grávidas de fetos do sexo feminino, não ocorrendo o mesmo com o sexo oposto, questionando-se a possibilidade de ocorrer influência do sexo fetal no curso da doença durante a gravidez.
Beecroft et al. (39) através de estudo cego prospectivo avaliaram 34 pacientes com asma durante a gravidez, entre 25-34 anos, no segundo trimestre da gravidez (12-21 semanas), sob tratamento regular. Destas, doze não utilizavam regularmente corticóides por inalação antes da gravidez, dezesseis inalavam de 200-500 mcg diariamente e seis mais de 500 mcg/dia. Nenhuma recebia corticóide por via oral. O estudo foi baseado em um qüestionário que avaliava tosse, dispnéia, despertar noturno, quantidade de medicamentos e o número de visitas ao ambulatório, em decorrência da asma.
Dezoito mulheres deram a luz a fetos do sexo masculino e dezesseis do sexo feminino. Um número igual de mães de meninos e meninas não relataram mudanças na sintomatologia da asma. Entretanto, quatro de dezoito mães de meninos informaram piora nos sintomas e oito melhora. Oito mães de recém-natos do sexo feminino relataram piora e nenhuma referiu melhora. Os autores acreditam que mulheres grávidas de meninos apresentam um curso mais favavorável da asma durante a gravidez em decorrência da produção de androgênio pelos fetos masculinos. Os qüestionários foram respondidos entre a 12ª e 16ª semanas quando naturalmente ocorre um pico na secreção androgênica. Esta associação deverá nortear novos estudos.
Os resultados de Beecroft et al. foram confirmados por Dodds et al. (40) que haviam previamente publicado um estudo em que avaliavam os efeitos perinatais de drogas utilizadas para o tratamento da asma durante a gravidez, na população de Nova Scotia, Canadá (41). Na reanálise destes dados, desta feita considerando o sexo fetal, puderam constatar que 14% das mulheres grávidas de fetos masculinos necessitaram de corticóides durante a gravidez enquanto que naquelas grávidas de fetos femininos este valor alcançou 20%. Embora igual proporção de grávidas de fetos masculinos e femininos não necessitassem de medicação específica para a asma durante a gravidez, mães de fetos femininos necessitaram utilizar mais beta-agonistas (40%) como única terapêutica do que grávidas de meninos (35%).
Efeitos do fumo na Asma durante a Gravidez
Vários estudos demonstram maior risco de mortalidade perinatal, prematuridade e baixo peso fetal associado ao hábito de fumar, sendo este risco maior nas grávidas com asma e que fumam (42-45).
Os receptores b2 adrenérgicos estão presentes tanto na musculatura lisa das vias aéreas como na musculatura uterina, sendo que a disfunção deste receptor pode explicar tanto a hiperresponsiviade brônquica como o maior índice de trabalho de parto prematuro encontrado nas grávidas que fumam e sofrem de asma (46). O mais relevante é que dois estudos demonstraram hiperresponsividade em mulheres sem asma que desenvolveram trabalho de parto prematuro (47-48).
O maior risco de fetos natimortos e mortalidade perinatal entre mães que fumam é explicado pela restrição do crescimento fetal intrauterino, prematuridade e descolamento prematuro da palcenta (DPP) (49-50). O fumo materno está associado a hipóxia fetal devido a redução do fluxo sanguíneo úteroplacentario e o aumento da resistência vascular pode parcialmente explicar a associação entre fumo e baixo crescimento fetal e também pode contribuir para o aumento do risco de DPP (51-52).
Anterior << Asma Grave em Adultos
Informações Médicas
Home
Próximo >> Asma no Idoso
Bibliografia:
01.Kwon HL, Belanger K, Bracken MB. Asthma prevalence among pregnant and childbearing-aged women in the United States: estimates from national helath surveys. Ann Epidemiol 2003; 13:317-24.
02.Murphy KJ, Kazerooni EA, Braun MA, Weinberg EP, Killan DA, Hendrick WJ. Radiographic appearance of intrathoracic complications of pregnancy. Can Assoc Radiol J 1996; 47:453.
03.Hernandez E, Angell CS, Johnson JWC. Asthma in pregnancy-current concepts. Obstet Gynecol 1980; 55:739.
04.Williams DA. Asthma and pregnancy. Acta Allergol 1967; 22:311.
05.Nelson HS, Weber RW. Endocrine aspects of allergic diseases. In Bierman CW, Pearlman DS, eds. Allergic Diseases From Infancy to Adulthood. Philadelphia:WB Saunders, 1988,ch15.
06.Banha SL, Bjerkdal T. The course and outcome of pregnancy in women with bronchial asthma. Acta Allergol 1972; 27:397 .
07.Liccardi M, D'Amato M, D'Amato G. Asthma in pregnant patients: pathophysiology and management. Monaldi Arch Chest Dis 1998; 53:151.
08.Stenius-Aarniala R, Pirila P, Teramo K. Asthma and pregnancy: a prospective study of 198 pregnancies. Thorax 1988; 43:12.
09.Rezende J, Linhares E. Endocrinologia do Ciclo Gravídico. In : Jorge de Rezende. Obstetrícia . 3ª edição. Rio de Janeiro:Ed. Guanabara Koogan S.A; 1977:116.
10.Cagal DW, Frank NR, Gaensler EA et al. Pulmonary function in pregnancy. I. Serial observations in normal women. Am Rev Tuberc 1953; 67:568.
11.Rees GB et al. A longitudinal study of respiratory changes in normal human pregnancy with cross-sectional data on subjects with pregnancy-induced hypertension. Am J Obstet Gynecol 1990; 162:826.
12.Fadel HE, et al. Normal pregnancy: a model of sustained respiratory alkalosis. J Perinat Med 1979; 74:195.
13.Liberatore SM. Respiratory function during pregnancy. Respiration 1984; 46:145.
14.Alaily AB, Carrol KB. Pulmonary ventilation in pregnancy. Br J Obstet Gynaecol 1978; 85:518.
15.Baldwin GR et al. New lung functions and pregnancy. Am J Obstet Gynecol 1977; 127:235.
16.National Asthma Education Program Working Group on Asthma and Pregnancy. National Management of Asthma During Pregnancy. Bethesda, MD, NIH Publication No. 93-3279A, 1992.
17.Milne JÁ et al. The effect of human pregnancy on the pulmonary transfer factor for carbon monoxide as measured by single-breath method. Clin Sci Mol Med 1977; 53:271.
18.Jellyman JK, Gardner DS, Edwards CM, Fowden AL, Giussani DA. Fetal cardiovascular, metabolic and endocrie responses to acute hypoxaemia during and following maternal treatment with dexamethasone in sheep. J Physiol 2005; 567:673.
19.Rezende J, Nahoun JC. Trocas Materno-Ovulares. In : Jorge de Rezende. Obstetrícia . 3ª edição. Rio de Janeiro: Ed. Guanabara Koogan S.A.;1977:74.
20.Sinert R, Stavile KL, Han JH. Acute Asthma in Pregnancy. In : Barry E. Brenner. Emergency Asthma . 1 st . Ed. New York; 1999:443.
21 .Schatz M. Asthma during pregnancy: interrelationships and management. Ann Allergy 1992; 68:123.
22.Sorri M, Hartikainen-Sorri AL, Karja J. Rhinitis during pregnancy. Rhinology 1980; 18:83.
23.Hubl W, Buchner M, Bellee H et al. Study of plasma aldosterone in normal pregnancy, in pre-eclamptic women, and cord plasma of newborns. Endokrinologie 1979; 73:162.
24.Clemens LE, Stteri PK, Stites DP. Mechanism of immunosuppression of progesterone on maternal lymphocyte activation during pregnancy. J Immunol 1979; 122:1978.
25.Fortser PS, Goldie RG, Patterson JW. Effect of steroids on beta-adrenoceptor-mediated relaxation of pig bronchus. Br J Pharmacol 1983; 78:441.
26.Piccinni MP, Giudizi MG, Biagiotti R et al. Progesterone favors the decelopment of human T helper cells producing Th2-type cytokines and promotes both IL-4 production and membraneCD30 expression in established Th1 cell clones. J Immunol 1995; 155:128.
27.Luppi P, Haluszczak C, Trucco M, Deloja JA. Normal pregnancy is associated with peripheral leukocyte activation. Am J Reprod Imunol 2002; 47:72.
28.Rein DT, Schondorf T, Gohrioing UJ et al. Cytokine expression in peripheral blood lymphocytes indicates a switch to T (HELPER) cells in patients with preeclampsia. J Reprod Immunol 2002; 54:133.
29.Kapasi K, Albert SE, Yie S, Zavazava N, Librach CL. HLA-G has a concentration-dependent effect on the generation of an allo-CTL response. Immunology 2000; 101:191.
30.Schatz M, Dombrowski MP, Wise R, Thom EA, Landon M, Mabie W, Newman RB et al. Asthma morbidity during pregnacy can be predicted by severity classification. J Allergy Clin Immunol 2003; 112:283-8.
31.Schatz M, Hoffman E, Zeiger RS. The course and management of asthma and allergic diseases during pregnancy. In Middleton E, Reed CE, Ellis EF, eds. Allergy: Principles and Practice. St. Louis, Mosby Year Book Inc,1988 .
32.National Asthma Education Program Report of the Working Group on Asthma and Pregnancy. Bethesda, MD: NTH Publication 93-3279, September 1993; 1-47.
33.Hollingsworth HM, Irwin RS. Acute respiratory failure in pregnancy. Clin Chest Med 1992; 13:723.
34.Rizk NW, Kalassian KG, Gilligan T, Druzin MI, Daniel DL. Obstetric complications in pulmonary and critical medicine. Chest 1996; 110:791.
35.Prowse CM, Gaensler ES. Respiratory and acid-base changes during pregnancy. Anesthesiology 1965; 26:381.
36.Shams M, Kilby MD, Somerset DA, Howie AJ, Gupta A, Wood PJ, Afnan M, Stewart PM. 11Beta-hydroxysteroid dehydrogenase type 2 in human pregnancy and reduced expression in intrauterine growth restriction. Human Reprod 1998; 13:799.
37.Murphy VE, Gibson PG, Giles WB, Zakar T, Smith R, Bisits AM, Kessell CG, Clifton VL. Maternal asthma is associated with reduced female fetal growth. Am J Respir Crit Care Med 2003; 168:1317.
38.ChaoTC, Van Alten PJ, Greager JA, Walter RJ. Steroid sex hormones regulate the release of tumor necrosis factor by macrophages. Cell Immunol 1995; 160:43.
39.Beecroft N, Cochrane GM, Milburn HJ. Effect of sex of fetus on asthma during pregnancy: blind prospective study. BMJ 1998; 317:856.
40.Dodds L, Armson BA, Alexander S. Use of asthma drugs is less among women pregnant with boys rather than girls. BMJ 1999; 318:1011.
41.Alexander S, Dodds L, Armson BA. Perinatal outcomes in women with asthma during pregnancy. Obstet Gynecol 1998; 92:435.
42.Shah NR, Bracken MB. A systemic review and meta-analysis of prospective studies on the association between maternal cigarette smoking and preterm deliveries. Am J Obstet Gynecol 2000;182:465–72.
43.Pollack H, Lantz PM, Frohna JG. Maternal smoking and adverse outcomes among singletons and twins. Am J Public Health 2000;90:395–400.
44.Magee BD, Hattis D, kivel NM. Role of smoking in low birth weight. J Reprod Med 2004;49:23–7.
45.Okah FA, Cai J, Hoff GL. Term-gestation low birth weight and health-compromising behaviors during pregnancy. Obstet Gynecol 2005;105:543–50.
46.Schatz M. Is maternal asthma a life or death issue for the baby? Thorax 2009;64:93-5.
47.Bertrand JM, Riley SP, Popkin J, et al.. The long-term pulmonary sequelae of prematurity: the role of familial airway hyperreactivity and the respiratory distress syndrome. N Engl J Med 1985;312:742–5.
48.Riedel F, Achenbach U, Rieger CHL. Prematurity and maternal bronchial hyperresponsiveness, J Perinat Med 1989;17:151–5.
49.Schatz M, Zeiger RS, Hoffman CP, et al.. Perinatal outcomes in the pregnancies of asthmatic women: a prospective cont


Nenhum comentário:
Postar um comentário